超声诱导血脑屏障NIR-II荧光显像用于ICG微泡光热治疗胶
本文要点:聚焦超声(FUS)诱导的血脑屏障(BBB)的打开是增强胶质母细胞瘤(GBM)治疗的关键。然而,一种具有高时空分辨率的体内成像方法仍然缺乏原位同步监测血脑屏障打开过程。在本文中,作者报道了使用吲哚菁绿掺杂微泡(MBs-ICG)可视化FUS诱导的血脑屏障的打开和增强对抗GBM的光热治疗(PTT)。MBs-ICG在第二近红外窗口(NIR-II)显示明亮的荧光,超声对比和超声诱导的尺寸转换特性。MBs-ICG利用互补的对比度特性,可成功应用于脑血管成像,NIR-II荧光分辨率为168.9 lm,超声穿透深度为~7mm。作者进一步证明MBs-ICG可以与FUS结合,在NIR-II荧光信本比为6.2±1.2的情况下,对血脑屏障开口进行原位同步可视化。最后,作者的数据表明,在FUS照射下,MBs-ICG转化为脂质-icg纳米颗粒,并在10min内迅速穿透肿瘤组织,增强原位GBM小鼠的PTT。多功能MBs-ICG方法为监测血脑屏障开放和强化GBM治疗提供了一种新的范例。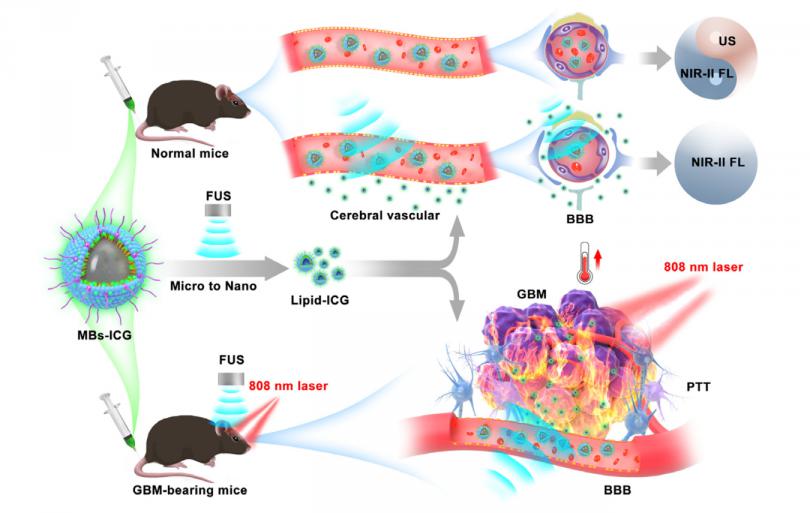
背景:作者开发了吲哚菁绿掺杂微泡作为BBB开口的辅助试剂和用于同步可视化FUS诱导的BBB开口的NIR-II成像剂原位,通过FUS有效打开肿瘤BBB,增强原位胶质瘤的光热效应。
简介:胶质母细胞瘤(GBM)是一种高度侵袭性和预后不良的脑肿瘤,全qiu范围内五年生存率为<5%,中位总生存期为14-17个月。GBM的治疗仍然具有挑战性,因为抗ai药物通过血脑屏障(BBB)的递送有限。微气泡(MBs)与聚焦超声(FUS)相结合是一种有吸引力的非侵入性方法,用于诱导短暂的BBB开放并增强GBM治疗的药物递送。与其他方法相比,这种物理方法显示出非侵入性,位点特异性和可逆性的优点,例如化学处理,纳米药物递送和光热处理。FUS介导的BBB开口的可视化有助于提高安全性,并阐明提高GBM治疗效果的机制。目前,几种成像方法,包括磁共振成像(MRI),光声(PA)成像和单光子发射计算机断层扫描(SPECT)成像,已被用于监测FUS诱导的BBB开口。然而,这些方法通常存在需要使用辐射、时间要求严格和分辨率低等问题。
第二近红外窗口(NIR-II,1000-1700nm)中的荧光成像是一种先进的光学成像技术,具有无辐射,实时操作和高时空分辨率的优点。它在科学研究中备受关注,并已应用于临床试验。最近,Li等人改进了NIR-II探针,用于监测FUS诱导的BBB的打开和恢复,具有快速反馈和高分辨率的特点。然而,作为成像探针的NIR-II纳米颗粒和作为BBB开口辅助试剂的微气泡在体内表现出不同的药代动力学,这使得FUS诱导的BBB开口难以同步监测。
在这项工作中,作者报道了吲哚菁绿(ICG)负载的脂质微泡(MBs-ICG)用于FUS诱导的BBB打开和原位可视化,以及增强光热疗法(PTT)对GBM的作用。ICG是一种经美国食品和药物管理局(FDA)批准用于体内临床应用染料,具有明亮的NIR-II荧光和高效的光热性能。MBs-ICG与FUS结合不仅可以打开BBB,而且在FUS照射下MBs-ICG转化为脂质-ICG纳米颗粒(NPs),用于BBB开口的NIR-II荧光可视化和增强PTT对GBM的抑制。作者评估了MBs-ICG在正常小鼠和原位GBM小鼠模型中的成像和治疗潜力,为监测BBB开放和加强GBM治疗提供了一种可视化方法。
实验:
1.甲基溴-ICG的制备
作者采用薄膜水化和机械振动的方法制备了MBs-ICG。简而言之,适量的DSPC,DSPE-PEG2000,和ICG(摩尔比= 10:1:1)在试管中与氯仿混合。然后,将混合溶液在N2气体,直到在管壁上产生磷脂膜。随后,将干燥的脂质膜在真空下保持3-4小时。氯仿完全挥发后,将所得脂质膜在TRIS缓冲液中水合。然后,将1mL水性脂质体悬浮液加入密封小瓶中,用全氟丙烷 (C3F8) 气体。最后,将小瓶在机械摇床中机械振动45秒。成功制备的MBs-ICG储存在冰上。整个过程是在没有光线的情况下进行的。
2.甲基安尼加仑山甲的表征
通过荧光显微镜研究了MBs-ICG的表面形貌。使用JEM-1200EX显微镜获取脂质-ICG制剂的透射电子显微镜(TEM)图像。使用用游离ICG制备的吸光度标准曲线定量MBs-ICG中ICG的含量。分别用分光荧光计和紫外分光光度计对相同ICG浓度的MBs-ICG和游离ICG的荧光光谱和吸收光谱进行了表征。MBs-ICG和脂质-ICG的流体动力学尺寸使用Nano-ZS90通过动态光散射(DLS)进行评估。MBs-ICG的浓度使用AccuSizer 780APS计数器测量。基于宽带脉冲法测定MB的谐振频率。
3.MBs-ICG的体外性能
MBs-ICG和SonoVue的超声性能使用VisualSonicsVevo 2100成像系统进行了测试。简而言之,将MB以增加的浓度(1×104,1×105,1×106和1×107气泡/毫升)。从凝胶侧面采集超声图像,并通过Vevo LAB软件分析超声信号强度。市售的SonoVue MB作为对照。通过体内荧光成像系统和NIR-II荧光成像系统获取不同浓度的MBs-ICG和脂质-ICG(MBs-ICG碎裂)溶液的NIR-I/NIR-II窗口中的荧光图像。
4.体外光热效应
使用近红外热像仪研究了PBS和MBs-ICG的光热特性。首先,将溶液中的100μL加入管帽中,并用808nmNIR激光器处理180秒,在激光照射期间,成像仪相机将自动记录溶液中的温度变化并提供实时热成像。最后,得到不同时间间隔的样品溶液的光热加热曲线。
5.细胞培养
荧光素酶标记的GL261 GBM细胞系(GL261-Luc)和bEnd.3脑微血管内皮细胞系取自美国型培养物保藏(ATCC)。将细胞在完全高糖DMEM中培养,其中包含10%热灭活FBS,90%基础DMEM和青霉素-链霉素,后者在使用前制备。此外,胰蛋白酶-EDTA用于消化细胞,PBS缓冲液用于洗涤细胞。细胞培养按复苏、传代和冷冻保存过程进行。允许细胞在含有5%CO2的加湿培养箱中生长在37°C。所有细胞操作均无菌进行。
6.动物模型
所有动物试验均获得深圳市先进技术研究院和中国科学院动物护理和使用委员会的批准。雌性C57BL/6J小鼠(6-8周)从北京维塔尔河实验动物科技有限公司(中国)获得。所有小鼠都可以免费摄入标准饲料和无菌水。构建脑镜灌注成像颅窗模型。与软组织的深度穿透相反,由于超声能量的强烈衰减,颅骨存在的超声穿透受到限制。简而言之,在深度麻醉的小鼠中钻出直径在5-6mm范围内的颅骨孔,而没有脑组织出血或损伤。在手术过程中,头骨撒上盐水溶液以保持清洁并保持低温,同时给予利多卡因以缓解疼痛。实验结束后,对小鼠进行保温和抗炎治疗,并定期监测其生命体征。
通过将GL261-Luc细胞原位注射到小鼠脑纹状体中建立原位GBM模型。简而言之,脱毛后,用异氟醚气体麻醉小鼠,并将头部固定在立体定向装置上(RWD生命科学,中国深圳)。在对皮肤进行消毒并做切口后,将微量注射器定位在脑组织上(前膛:3.0毫米,矢状缝合线:2.0毫米,深度:3.5毫米)。随后,大约 5.0 × 105在5分钟内缓慢注射5μL中的GBM细胞以保持颅内压稳定。通过生物发光成像和H&E染色检测颅内GBM细胞的增殖。
7.体内超声灌注成像
脑脉管系统的超声图像是通过钻孔窗口获得的,使用配备18MHz高频换能器的 VisualSonics Vevo 2100 成像系统。在将换能器放在头部之前,将偶联剂轻轻地涂在颅窗上。注射MBs-ICG后(200μL的1×109气泡/mL),超声成像的实时性允许在30分钟内可视化流经大脑微脉管系统的MB。重要的是,成像参数在实验过程中保持一致。此外,通过成像系统记录和分析不同时间点的超声灌注图像。从B模式成像数据分析颜色编码的参数图像以显示脑灌注。
8.脑血管系统的NIR-II荧光成像
脱毛后,将小鼠置于俯卧位,并通过尾静脉注射MBs-ICG或游离ICG(ICG剂量=1.5mg/kg)。使用NIR-II荧光成像系统(以不同的时间间隔获取具有完整颅骨的脑血管结构的NIR-II荧光图像)。
9.FUS诱导的BBB通路
超声刺激由频率为1 MHz的FUS换能器产生,该换能器由超声神经刺激仪器驱动。换能器和颅骨之间的空间充满了无气泡偶联剂,以最大限度地提高超声传输。使用准直器引导FUS光束聚焦在参考点上(前膛:3.0毫米,矢状缝合线:2.0毫米,深度:3.5毫米)。通过观察通过尾静脉向小鼠施用Evans Blue染料(剂量=0.1mg/kg)后脑组织是否染有蓝色斑点来判断BBB的开口,并在2小时后处死小鼠。FUS诱导的BBB开口的安全性通过H&E和TUNEL染色确定。
10.FUS诱导BBB开口的NIR-II.荧光成像
使用暴露的剃光头的健康C57BL / 6J小鼠监测FUS诱导的BBB开放过程。静脉注射MBs-ICG后(1×109气泡/mL),麻醉小鼠在不同声压(0.28、0.36和0.46MPa)下用FUS以1 MHz频率刺激2min。超声超声处理的脉冲长度为10ms,脉冲重复频率为1Hz。使用体内荧光成像系统(Ex,745 nm;Em,840 nm)和NIR-II荧光成像系统(Ex,808nm;长通滤光片,1300nm;曝光时间,200ms;功率密度,60mW/cm2),分别。在FUS超声处理后0、3、10、15、30、45、60、90和120分钟捕获图像。在这两种模式下采集的图像分别使用IVIS活体图像软件和ImageJ软件进行处理。
11.体内PTT
为了获得MBs-ICG的体内PTT能力,将携带GL261-Luc GBM的小鼠随机分为三组(每组5只):(一)PBS激光;(二)甲基溴-ICG激光;(三)MBs-ICG-FUS-激光器。脑肿瘤的位置由808nm激光(1W/cm)照射2,5分钟)注射后5分钟。在5分钟内,红外热像仪(Ti27,美国福禄克)捕获了照射部位的温度变化。此外,在激光照射后12小时处死携带GBM的小鼠,并收集脑组织进行H&E和TUNEL染色。
12.体外毒理学
通过将bEnd.3细胞与MBs-ICG(ICG浓度范围为6.25至100μg/ mL)孵育24小时来评估MBs-ICG的细胞毒性。CCK-8测定用于确定孵育后的细胞活力。此外,从小鼠血液中获得的红细胞与MBs-ICG(与上述ICG浓度相同)一起孵育以确定溶血率。在37°C孵育3小时后,用酶标仪测量吸光度,并计算不同组的溶血率。
13.体内毒性
为了评估MBs-ICG的生物安全性,将健康小鼠随机分为四组(每组5组):(一)空白对照(PBS);(二)甲基溴-ICG注射后一维;(三)甲基溴-ICG注射后的三维;(四)甲基溴-ICG注射后5-d。在所有实验中,MBs-ICG的ICG剂量为1.5mg/kg。经过上述处理后,收集血液样本进行常规血液检查。最后,收集小鼠的主要器官(心脏,肝脏,pi脏,肺和肾脏)进行H&E染色。
结果:
1.甲基溴-ICG的制备和表征
薄膜水合法用于制备MBs-ICG,使用FDA批准的赋形剂,包括DSPC,DSPE-PEG2000、ICG和C3F8气体(图1a)。荧光显微镜图像显示MBs-ICG分散良好,具有核/壳结构(暗C3F8 气体核心和脂质壳表现出明亮的荧光)(图1b)。使用动态光散射(DLS)测量MBs-ICG的平均流体动力学直径,导致1.0±0.17μm(图1c),小于商业MB的直径(例如SonoVue,尺寸= 2.5μm)。为了优化MBs-ICG的光学性能,作者研究了掺杂ICG浓度对MBs-ICG荧光强度的影响。最大化ICG荧光并减少聚集诱导荧光猝灭的最佳ICG浓度为1μg/ mL(图1d)。其次,测量了MBs-ICG和游离ICG的吸收光谱,结果表明,与游离ICG相比,MBs-ICG的吸收峰表现出从783 nm到785 nm的红移。在MBs-ICG的NIR-II窗口中检测到典型的拖尾荧光发射(图1e)。与相同浓度下的游离ICG相比,MBs-ICG的NIR-II强度提高了13.4%。一个可能的原因是,疏水单层MBs中的ICG重排抑制了ICG的分子聚集并增强了其荧光发射。最后,采用功率密度为1 W/cm的808 nm激光器照射,研究了MBs-ICG的光热性能2.MBs-ICG的光热温度在3 min内提高了39.4°C(图1f),显示出良好的光热性能。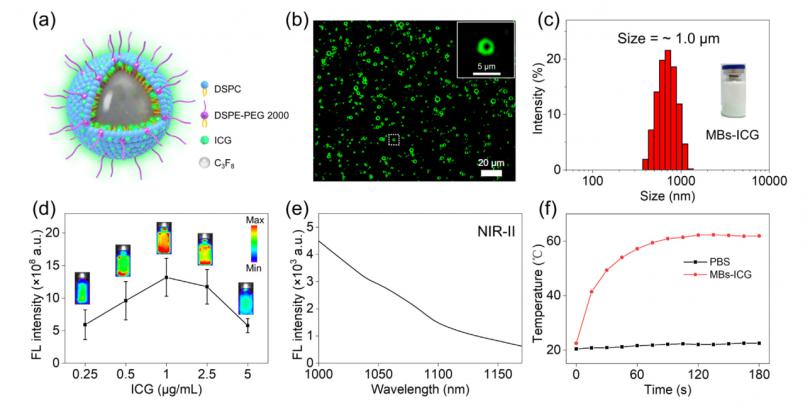
图1
2.MBs-ICG的超声和荧光特性
ICG掺杂到MB的脂质层中赋予它们超声波和荧光特性。首先,作者使用Vevo 2100高分辨率成像系统评估了MBs-ICG的超声特性,该系统显示出浓度依赖性对比度增强(图2a)。MBs-ICG的图像对比度与商业微泡相当(SonoVue,2.5μm)。然而,MBs-ICG(∼1 MHz)的谐振频率低于SonoVue(1.48–1.89 MHz)(图2b)。MBs-ICG频率的降低保证了超声成像和治疗的高组织渗透性和良好的生物安全性[38]。在频率为1 MHz的超声处理1 min后,MBs-ICG转化为脂质-ICG NPs。TEM和DLS测量表明,所得脂质-ICG NPs为球形,平均流体动力学直径为∼147 nm(图2c)。在转化过程中,脂质-ICG NPs的荧光在第一个近红外(NIR-I,650–950 nm)窗口和NIR-II窗口与MBs-ICG相比没有衰减(图2d和e)。这允许对具有深层组织穿透力(∼8 mm)的MBs-ICG进行NIR-II荧光成像(图2f和图)。S5在线)。综上所述,本研究制备的MBs-ICG具有良好的超声和荧光对比度以及超声诱导的尺寸转化特性。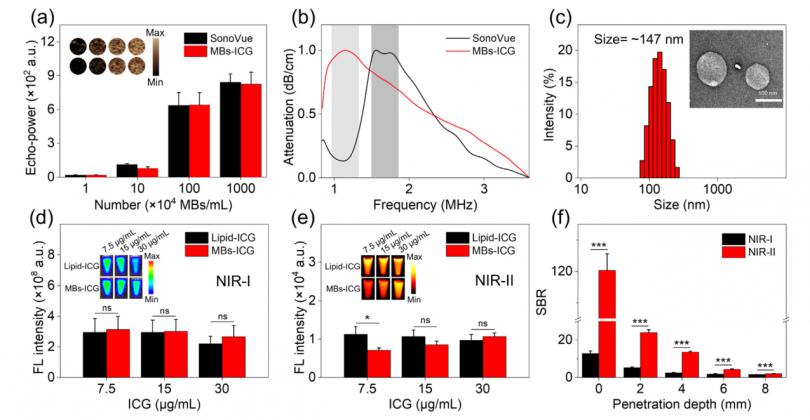
图2
3.脑血管系统的双模态成像
MBs-ICG优异的体外超声和NIR-II荧光性能允许进一步评估小鼠模型中的体内双模态成像。在MBs-ICG处理组中,用明亮的NIR-II荧光观察到脑血管结构,包括脑下静脉和头皮下的脑毛细血管,但在游离ICG处理组中则未观察到(图3a和图)。S6在线)。MBs-ICG处理小鼠的成像时间窗口达到30分钟,而游离ICG处理小鼠的相应值仅为5分钟。来自MBs-ICG处理的小鼠的脑血管系统图像的高斯拟合在治疗后1分钟提供了高达168.9μm的血管分辨率(图3b),为高分辨率脑血管成像提供了机会。接下来,我们进一步采用MBs-ICG的超声灌注成像来可视化颅窗小鼠模型中的脑脉管系统。MBs-ICG的成像时间窗口保持>30 min,成像深度达到∼7 mm(图3c和d),与NIR-II荧光成像相似。然而,由于超声成像的分辨率低,很难无创地获得脑血管结构的图像。综上所述,这些结果揭示了本研究制备的MBs-ICG在互补NIR-II荧光和超声脑血管成像方面的优势。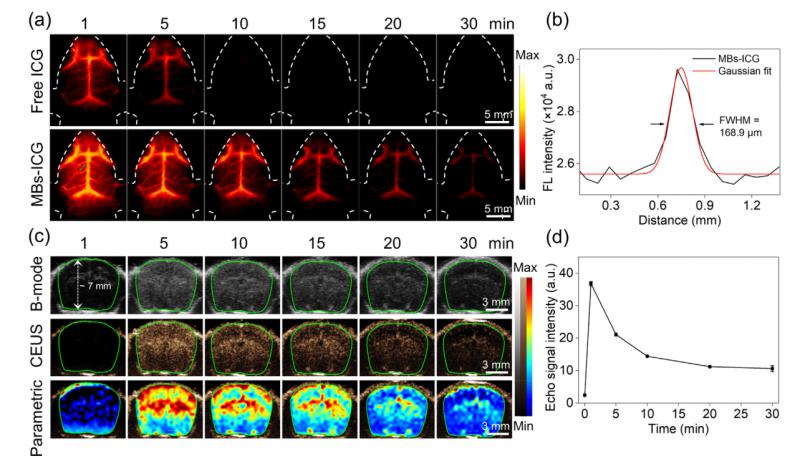
图3
4.MBs-ICG结合FUS进行BBB开口
MBs-ICG与FUS的组合用于小鼠模型中的BBB打开(图4a)。在这里,我们描述了遵循的一般程序。静脉注射MBs-ICG后对小鼠大脑进行超声处理2分钟(∼1×109气泡/毫升)。通过EB染色确认BBB的开放区域,并在脑组织的病理切片中评估超声处理过程的安全性。首先,使用校准的0.5毫米针式水听器研究了颅骨厚度对局灶性FUS区域的影响[39]。如图4b所示,在没有头骨的情况下,焦点直径为∼2.5 mm,在存在0.5 mm小鼠头骨的情况下,只有微小的尺寸和形状变形(图4c)。这一结果表明,小鼠头骨不影响BBB开口范围。接下来,我们采用EB染色来检测BBB渗透率[40],[41],[42]。MBs-ICG-FUS处理组在右半球显示一个蓝点,在FUS处理组中不存在,表明成功定位BBB开口(图4d)。此外,脑切片分析表明,BBB开口深度可以穿透整个脑组织(图4e)。最后,脑组织的H&E染色分析显示FUS诱导的BBB开放后没有出血,红细胞外渗或损伤(图4f)。这些结果表明,MBs-ICG与FUS相结合可以以非侵入性,特定地点和高度安全的方式打开BBB。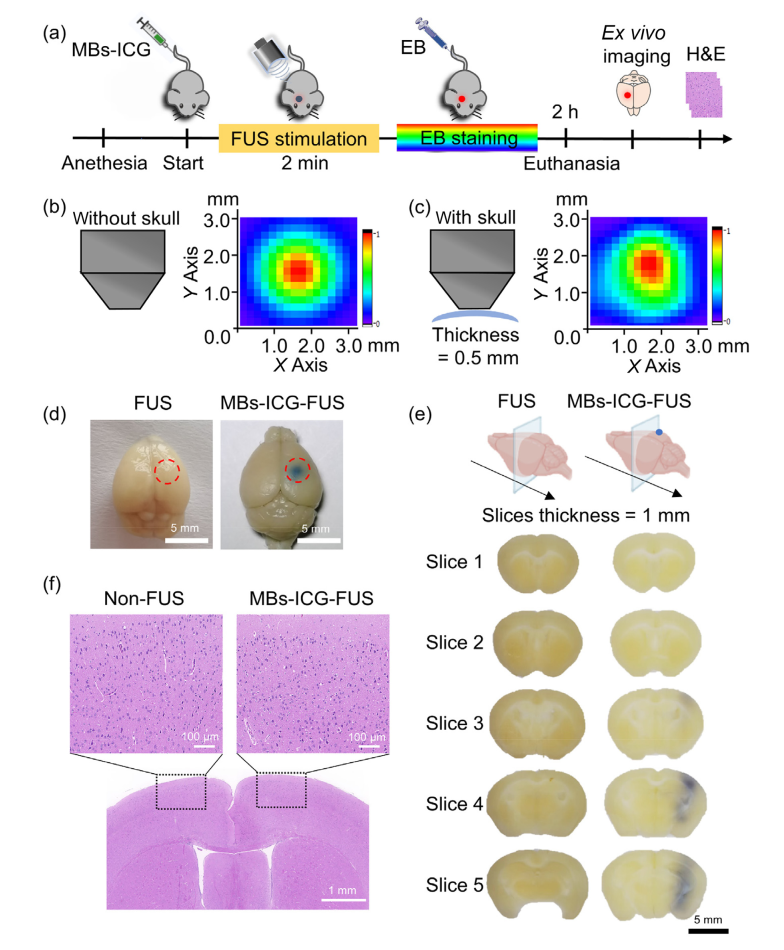
图4
5.FUS诱导BBB开口的体内NIR-II.荧光成像
在FUS照射下,MBs-ICG转化为脂质-ICG NPs(图2 c),这为使用脂质-ICG NPs的NIR-II荧光原位可视化BBB开口提供了极好的机会(图2d和e)。如图5a所示,NIR-II荧光在FUS处理区域立即增加。30分钟时,NIR-II荧光的信噪比(SBR)为6.2±1.2,比NIR-I荧光成像的信噪比(SBR = 1.4 ± 0.4)高约3.5倍(图5b)。结果表明,脂质-ICG NPs产生的NIR-II荧光在FUS诱导的BBB开口的原位同步监测方面优于NIR-I荧光[43]。离体脑NIR-II和NIR-I荧光成像进一步证实了上述结果(图5c和d)。值得注意的是,在FUS诱导的BBB打开和监测过程中仅使用了MBs-ICG,与以前的报告相比,这大大降低了操作的复杂性[18]。接下来,作者移动超声换能器(右,左和两侧)并改变声压(0.28,0.36和0.46 MPa)以控制FUS诱导的BBB开口的位置和范围。使用NIR-II荧光成像测量FUS诱导的BBB开口的直径,在三种不同的实验条件(0.28,0.36和0.46 MPa)下分别得到1.48,1.79和2.49mm(图5e和f)。此外,通过对FUS处理的脑组织的H&E和TUNEL染色分析未检测到组织损伤,出血或凋亡,显示出FUS联合MBs-ICG用于BBB开口的良好安全性能。
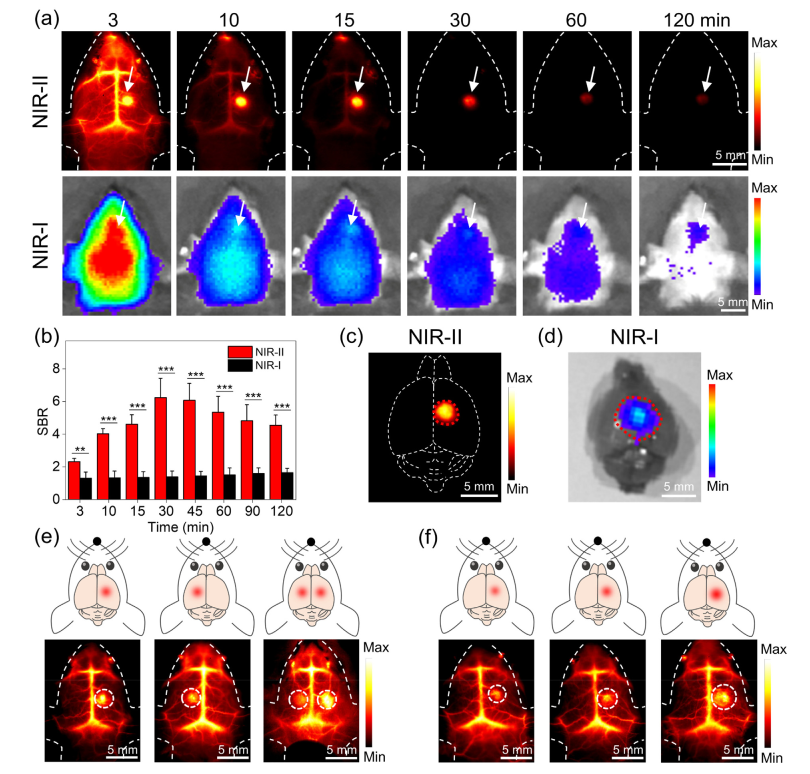
图5
6.GBM的体内PTT
MBs-ICG与FUS相结合,不仅可以用于原位打开和同步可视化BBB,还可以对GBM进行PTT。建立原位GBM小鼠模型以评估MBs-ICG的PTT电位(图6a)。生物发光成像和H&E染色分析显示GBM细胞在荷瘤小鼠中的增殖活性增加(图6b和c)。将GBM荷瘤小鼠随机分为两组(每组5只),如下所示:(i)MBs-ICG;(二) 甲基溴-ICG-FUS。如图6 d所示,在MBs-ICG处理组的脑肿瘤区域未观察到NIR-II荧光的显着增强,而在MBs-ICG-FUS组小鼠的肿瘤部位在10分钟内检测到强烈的NIR-II荧光.脑组织的离体NIR-II荧光成像进一步证实信号来自肿瘤组织(图6这一结果表明,由于大小限制,MBs-ICG无法进入脑肿瘤。然而,MBs-ICG在FUS照射下转化为脂质-ICG NPs可以增强其在脑肿瘤中的穿透和积累能力。值得注意的是,所提出的方法需要<10分钟才能将光热试剂递送到肿瘤组织,这将比以前的方法更有效。接下来,静脉注射MBs-ICG后,进一步获得原位GBM小鼠的PTT效率。在FUS诱导的BBB开口(808 nm,1 W / cm)后,作者使用NIR激光照射原位GBM区域5分钟2).通过红外热像仪监测不同处理过程中GBM区域的温度变化。如图6f所示,PBS激光组和MBs-ICG激光治疗组的GBM区域温度达到39-41°C。这样的温度低于42°C,无法产生可以杀死癌细胞的热疗。然而,在MBs-ICG-FUS-激光组中,在激光照射的5分钟内,脑肿瘤区域的温度从31.5°C迅速升高到50.6°C。其次,通过脑组织的TUNEL染色分析评估MBs-ICG的光热功效。如图6克,MBs-ICG-FUS激光组的肿瘤组织损伤和细胞坏死比其他组更严重。这些结果表明,MBs-ICG联合FUS可作为治疗小鼠模型GBM的有效热疗方法。
图6
7.甲基溴-ICG的毒性评价
作者首先使用细胞计数试剂盒-8来确定MBs-ICG对bEnd.3内皮细胞的细胞毒性作用。用不同浓度的MBs-ICG孵育24小时后,细胞活力保持在90%以上,表明MBs-ICG细胞毒性低。还使用小鼠来源的红细胞测量细胞溶血率。当MBs-ICG浓度达到100μg/mL时,观察到3%的溶血率,表明血液相容性良好。接下来,作者进一步评估了MBs-ICG在C57BL / 6J小鼠模型中的体内毒性。静脉注射浓度为∼1×10的MBs-ICG后9气泡/mL,在第1、3和5天采集血样进行常规血液检查。所有血液学指标,包括红细胞、HGB、周一、格兰、白细胞、淋巴、HCT、MCV、MCH、MCHC、PLT 和 RDW。在正常范围内,表明MBs-ICG未引起小鼠急性毒性。此外,MBs-ICG处理的小鼠在静脉注射MBs-ICG后24小时被安乐死,并通过H&E染色分析其主要器官,包括心脏,肝脏,脾zang和肺。结果表明,与对照组相比,MBs-ICG未导致主要器官的形态变化。综上所述,MBs-ICG具有优异的生物相容性,显示出广阔的临床应用潜力。
讨论:作者采用薄膜水合法制备了具有NIR-II荧光、超声对比度和超声响应特性的MBs-ICG。MBs-ICG可用于小鼠模型中脑血管结构的高分辨率NIR-II荧光成像和深度超声成像。MBs-ICG和FUS的组合以受控和位点特异性的方式打开小鼠的BBB,并且该过程可以通过NIR-II荧光原位同步可视化。这种简单有效的技术也可用于小鼠模型中脑肿瘤的PTT。为治疗诊断MBs-ICG为可视化FUS诱导的BBB开放和脑肿瘤的光疗提供了一种新工具。
参考文献
Liang, S.; Hu, D.; Li, G.; Gao, D.; Li, F.; Zheng, H.;Pan, M.; Sheng, Z., NIR-II fluorescence visualization of ultrasound-inducedblood-brain barrier opening for enhanced photothermal therapy againstglioblastoma using indocyanine green microbubbles. Sci Bull (Beijing) 2022,67 (22), 2316-2326.
⭐️ ⭐️ ⭐️
近红外二区小动物活体荧光成像系统 - MARS
NIR-II in vivo imaging system
高灵敏度 - 采用Princeton Instruments深制冷相机,活体穿透深度高于15mm
高分辨率 - 定制高分辨大光圈红外镜头,空间分辨率优于3um
荧光寿命 - 分辨率优于 5us
高速采集 - 速度优于1000fps (帧每秒)
多模态系统 - 可扩展X射线辐照、荧光寿命、一区荧光成像、原位成像光谱,CT等
显微镜 - 近红外二区高分辨显微系统,兼容成像型光谱仪
⭐️ ⭐️ ⭐️
恒光智影
上海恒光智影医疗科技有限公司,被评为“国家高新技术企业”,上海市"科技创新行动计划"科学仪器领域立项单位。
恒光智影,专注于近红外二区成像技术。致力于为生物医学、临床前和临床应用等相关领域的研究提供先进的、一体化的成像解决方案。自主研发近红外二区小动物活体荧光成像系统-MARS。
与基于可见光波长的传统成像技术相比,我们的技术侧重于X射线、紫外、红外、短波红外、太赫兹范围,可为肿瘤学、神经学、心血管、药代动力学等一系列学科的科研人员提供清晰的成像效果,助力科技研发。
同时,恒光智影还具备探针研发能力,我们已经成功研发了超过15种探针,这些探针将广泛地应用于众多生物科技前沿领域的相关研究中。
全部评论(0条)
推荐阅读
-
- 盈盛国产质构仪用于膏药贴剥离强度测试
- 盈盛恒泰ENS系列国产质构仪可以用于评估膏药贴的质量、还可以用于研究不同材料、工艺和配方对膏药贴黏附性能的影响,同时,它也可以帮助生产企业控制生产过程中的关键参数,确保产品质量的稳定性。
-
- 赛恺泽,ASCO,前沿技术……一起回顾细胞治疗2024高光时刻~~
- 赛恺泽,ASCO,前沿技术……一起回顾细胞治疗2024高光时刻~~
-
- 洁净生产 安全先行 | 防爆超声波清洗机全方位提升安全防护!
- 洁净生产 安全先行 | 防爆超声波清洗机全方位提升安全防护!
-
- 仪器推荐丨全功能模块化稳态瞬态荧光光谱仪FLS1000
- 激发和发射谱扫描、同步扫描、动力学测定、三维荧光光谱、近红外光谱测试
-
- 用户文章丨《Pediatr Blood Cancer.》王华教授团队应用超快三维荧光成像取得婴儿血管瘤临床检测标志物研究最新成果
- 重庆医科大学附属儿童医院王华教授团队应用长光辰英核心产品S3000超快三维荧光成像系统在《Pediatric Blood \x26amp; Cancer》期刊上发表了文章
-
- 热点应用丨基于空间位阻调节分子堆积的 NIR-II 荧光传感器用于体内癫痫可视化
- 荧光传感对于研究生物过程和诊断疾病至关重要,尤其是在背景信号可以变得较弱的第二近红外(NIR-II)窗口中。
-
- 解锁司法鉴定之谜:用于爆炸物和化学武器等的先进HPTLC技术
- 解锁司法鉴定之谜:用于爆炸物和化学武器等的先进HPTLC技术
-
- 应用分享丨微区X射线荧光技术揭示钙钛矿型薄膜的微观奥秘
- 应用分享丨微区X射线荧光技术揭示钙钛矿型薄膜的微观奥秘
-
- 人工智能辅助荧光图像分析省时省力
- 人工智能辅助荧光图像分析省时省力
①本文由医疗器械网入驻的作者或注册的会员撰写并发布,观点仅代表作者本人,不代表医疗器械网立场。若内容侵犯到您的合法权益,请及时告诉,我们立即通知作者,并马上删除。
②凡本网注明"来源:医疗器械网"的所有作品,版权均属于医疗器械网,转载时须经本网同意,并请注明医疗器械网(www.120med.com)。
③本网转载并注明来源的作品,目的在于传递更多信息,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品来源,并自负版权等法律责任。
④若本站内容侵犯到您的合法权益,请及时告诉,我们马上修改或删除。邮箱:hezou_yiqi





参与评论
登录后参与评论